Autores y titulares de los medicamentos aprobados entre 2010 y 2012 por la EMA. Fuente: Nature. |
Redacción. Madrid
El 61 por ciento de los medicamentos que recibieron una designación huérfana en Europa entre 2010 y 2012 procedían de pequeñas empresas, según un estudio publicado en la revista Nature y llevado a cabo por expertos de la Agencia Europea del Medicamento.
El trabajo pone de relieve la cada vez mayor importancia de las pymes (aquellas compañías que cuentan con menos de 250 trabajadores o facturan menos de 50 millones de euros anuales), de organismos como las instituciones académicas o de las asociaciones público-privadas en la innovación farmacéutica.
De los 18 medicamentos con designación huérfana aprobados en Europa en el periodo de estudio, 11 procedían de pequeñas empresas, y solo 4 de compañías de tamaño mediano-grande. Sin embargo, estas fueron las titulares del 78 por ciento de las solicitudes de comercialización, por el 22 por ciento de las pymes, lo que deja ver que la ‘Big Pharma’ sigue jugando un papel relevante en llevar el medicamento desde sus fases tempranas de desarrollo hasta la calle.
Licencias y adquisiciones
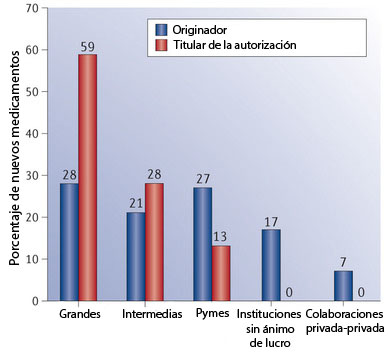
En total, entre 2010 y 2012 se aprobaron en Europa 94 medicamentos. 27 de ellos tuvieron su origen en pymes y 17 de instituciones sin ánimo de lucro (académicas, cuerpos públicos o colaboraciones público-privadas). Es decir, que casi la mitad de medicamentos aprobados procedían de fuera del ámbito de las grandes compañías farmacéuticas –el trabajo divide a estas en ‘grandes’ e ‘intermedias’–. Sin embargo, estas últimas dominaron en lo relativo a solicitudes de autorización, con 87 de las 94. Las pequeñas empresas solo fueron titulares del 13 por ciento, mientras que las instituciones sin ánimo de lucro, como es lógico, no figuran en este apartado.
Más de la mitad de moléculas (55 de 94) fueron objeto de transferencia entre entidades, la mayor parte (18, el 33 por ciento) pasaron de pymes a manos de grandes empresas. Esto se produjo a través de licencias (en 13 de los 18 casos) y absorciones del laboratorio pequeño por el mayor (en 5 casos). En cuanto a las organizaciones sin ánimo de lucro, el 81 por ciento de sus productos fue a parar a manos de grandes empresas.
El trabajo (firmado por Helene Lincker, Constantinos Ziogas, Melanie Carr, Nuria Porta y Hans-Georg Eichler) también analiza el origen geográfico de las moléculas aprobadas, procediendo casi la mitad de ellas (45 por ciento) de Norteamérica (EE UU y Canadá) y algo menos (37 por ciento) de Europa. Un 10 por ciento provenía de otros países como Japón, China, Israel y Australia, destacando los autores que el número de fármacos aprobados año a año se fue incrementando de forma notable.